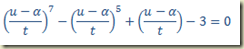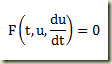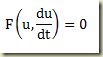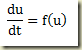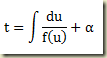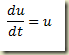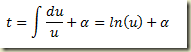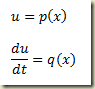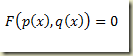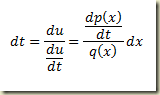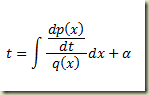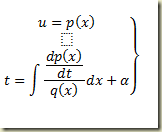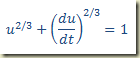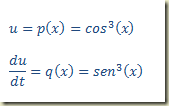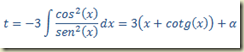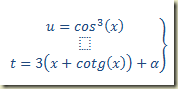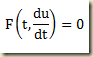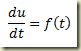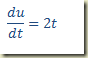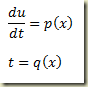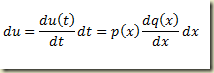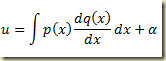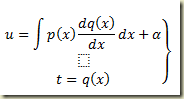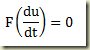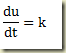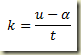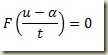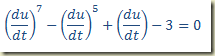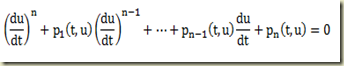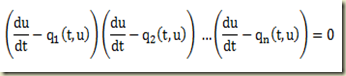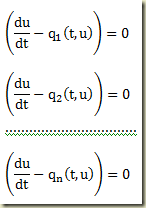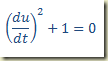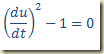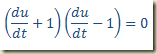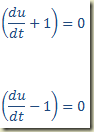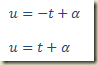Considere novamente a equação diferencial de primeira ordem em sua forma geral
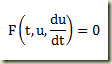
Para que a equação acima seja uma equação diferencial, o único termo de presença realmente obrigatória é a derivada.
CASO 1 – Equações sem a variável independente
Se faltar a variável independente, t, a equação fica
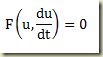
Se a equação representar um sistema dinâmico, a presença da variável independente, t, na equação indica existe um agente externo atuando sobre o sistema. Neste caso o sistema é dito não autônomo. A ausência da variável independente indica ausência de um agente externo agindo sobre o sistema. Neste caso, o sistema é dito autônomo.
a) derivada explicitável
Se a derivada for explicitável, então a equação acima fica
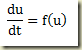
Para resolvê-la basta realizar a quadratura
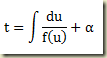
Exemplo – Considere a equação
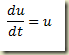
Neste caso,
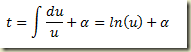
b) derivada não explicitável
O problema surge quando não há como explicitar a derivada. Neste caso o roteiro é outro e envolve a definição das funções paramétricas
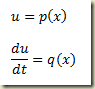
Estas funções devem ser tais que
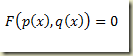
Neste caso, a seguinte relação é muito útil:
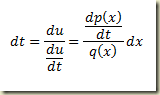
Integrando em relação a x (variável paramétrica) resulta
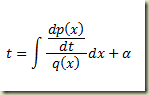
A solução geral será o par de equações.
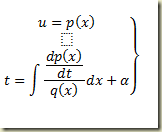
Se for possível eliminar a variável para métrica x obtém-se a solução geral na forma habitual. O que fica bem claro é que as equações paramétricas dependem da escolha de p(x) e q(x). O exemplo a seguir ilustra isso.
Exemplo – Considere a equação diferencial
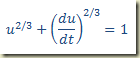
Não foi testado se a derivada pode ser explicitada, mas a impressão que se tem é que, se for, a explicitação vai exigir um bocado de algebrismo. Isso, porém, não importa no momento em que apenas o método de solução está sendo considerado. Olhando para equação um possível par de equações paramétricas é:
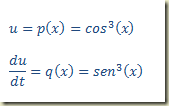
Inserindo na equação diferencial observa-se fácilmente que ela se transforma na identidade
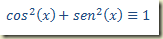
Seguindo o roteiro escrito acima tem-se que:

Integrando resulta
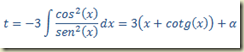
A solução geral da equação deste exemplo é, portanto, dada pelo par paramétrico
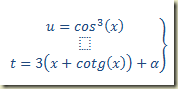
CASO 2 - Equações sem a função desconhecida
A forma geral destas equações é
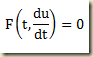
A situação é bem parecida com o caso anterior.
a) Derivada explicitável
Se a derivada for explicitável, então,
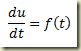
A solução geral pode ser obtida por uma simples quadratura, que pode não ser tão simples.
Exemplo – Considere a equação
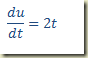
Por uma simples integração resulta

Então a solução geral desta equação é
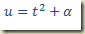
b) Derivada não explicitável
Se a derivada não puder ser explicitada temos um caso semelhante ao anterior. Logo,
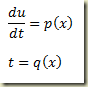
O roteiro a seguir é um pouco modificado. Fazendo:
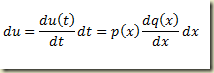
Integrando resulta:
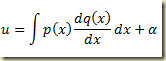
Então a solução édada pelo par
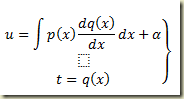
Esta é a solução geral procurada.
CASO 3 – A equação só possui a derivada
Se a equação contiver apenas a derivada
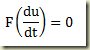
Trata-se de uma equação que deve ser resolvida como uma equação algébrica resultando um valor numérico para a derivada. Este valor pode existir ou não. Se existir pode ser um ou mais de um. Não importa, seja k este valor. Neste caso,
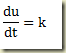
Integrando aparece como solução
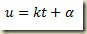
Neste caso,
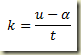
Inserindo esta relação na equação original obtém-se a solução geral
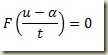
Esta é a equação da família de curvas a um parâmetro que satisfaz esta equação diferencial. Sendo, portanto, a solução geral da equação.
Exemplo – Considere a equação diferencial
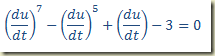
Esta equação só contém a derivada e cai no caso acima. Então basta substituir a derivada para obter a solução geral