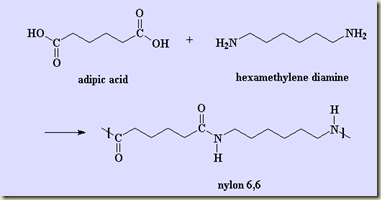
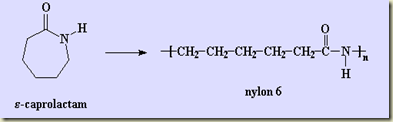
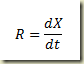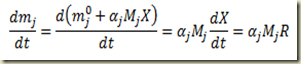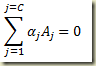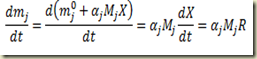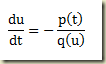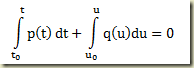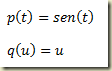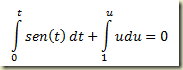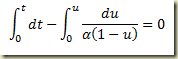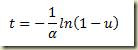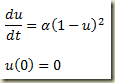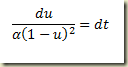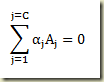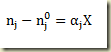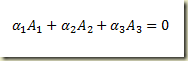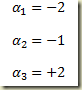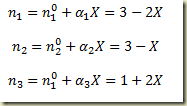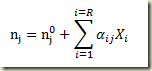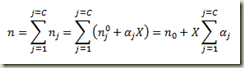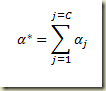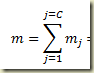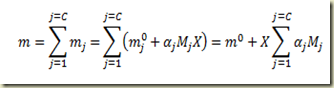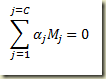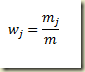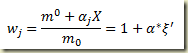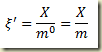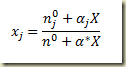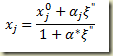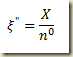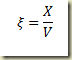Como foi visto, os sistemas termodinâmicos podem ser abertos e fechados. Os sistemas abertos permutam matéria com sua vizinhança, os fechados não. Nos sistemas fechados a massa do sistema não pode variar, nos sistemas abertos pode.
Se o sistema for multicomponente a composição dos sistemas abertos só pode ser alterada se houver transferência seletiva de componentes o que ocorre na transferência por difusão molecular. Na transferência puramente convectiva a composição não se altera, mas a massa do sistema sim. Se o sistema for fechado, nem há como a composição variar salvo se no sistema estiver ocorrendo uma reação. Neste caso, alguns componentes, conhecidos, como reagentes, se transformam em outros componentes, conhecidos como produto. A reação é então representada como visto no item TD 013.
Considere novamente um sistema fechado homogêneo e uniforme, formado por C componentes, onde ocorre a reação simples abaixo
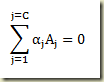
Os coeficientes estequiométricos obedecem a convenção de que são positivos para produtos, negativos para reagentes e nulos para inertes.
A lei das proporções definida de Proust estabelece que
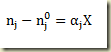
Na expressão acima n é o número de moles, o subíndice j indica o componente e o sobre índice 0 se refere ao tempo inicial. O parâmetro X é chamado extensão da reação, também conhecido como grau de avanço da reação. A formula acima pode ser escrita
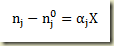
Exemplo – Considere a reação
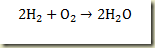
Esta reação pode ser escrita da seguinte forma
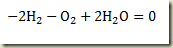
Atribuindo ao hidrogenio o indice 1, ao oxigenio o indice 2 e à agua o indice 3 resulta:
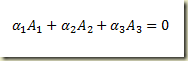
onde
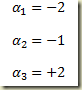
são os valores dos coeficientes estequiométricos para este caso específico. Admitindo que no tempo inicial os números de moles de hidrogênio, oxigênio e água sejam respectivamente, 3 moles, 3 moles e 1 mol e aplicando a Lei das proporções definidas resulta:
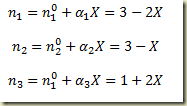
Os números de moles iniciais e os coeficientes estequiométricos são constantes, mas o grau de avanço é função do tempo.
Para sistemas multireagentes, a lei das proporções definidas de Proust fica:
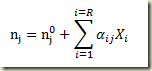
Na expressão acima o índice i indica reação e cada reação tem o seu grau de avanço. Sistemas multireagentes serão vistos mais adiante.
· Número de moles, grau de avanço e massa
Considere a relação de Proust
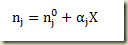
Para relacionar o grau de avanço com a variação do número de moles total existente no sistema basta somar. Disto resulta que:
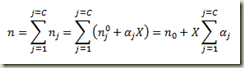
Fazendo
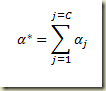
a expressão fica
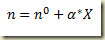
Para estabelecer a relação entre a massa do componente e o grau de avanço basta multiplicar os dois membros desta última equação pela massa molecular do componente. Assim
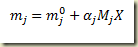
Para estabelecer a relação entre a massa do sitema e o grau de avanço basta lembrar que
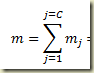
do que resulta
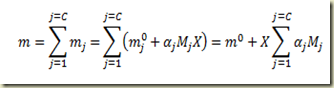
No entanto, pela lei da conservação da matéria e da espécie atômica
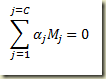
Disto resulta que
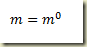
Neste ponto é bom lembrar que tudo o que foi dito acima só se aplica a sistemas reagentes fechados. Na sequencia o grau de avanço vai ser relacionado com as frações molares e mássicas.
Para estabelecer a relação entre o grau de avanço e as frações molares e mássicas o ponto de partida é a definição destas frações. No caso da fração massica
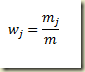
Inserindoi a relação entre a massa do componente num sistema e o grau de avanço na expressão e elmbrando que a massa do sistema não varia com o grau de avanço então
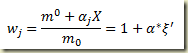
Nesta expressão
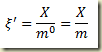
é o grau de avanço intensivo referido a unidade de massa do sistema.
Partindo agora da definição da fração molar
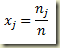
inserindo as relações entree moles e grau de avanço resulta
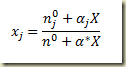
ou melhor
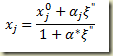
onde
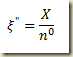
é o grau de avanço intensivo molar. Estas relações acima são importantíssimas no estudo termodinâmico de sistemas reagentes.
Apenas para finalizar voltando a expressão do número de moles do componente
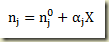
e divindo por V o volume do sistema resulta
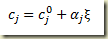
onde c representa a concentração molar. Neste caso,
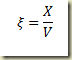
é o grau de avanço intensivo volumétrico. Este grau de avanço não é uma grandeza muito boa de se lidar em sistemas reagente não isocórico.