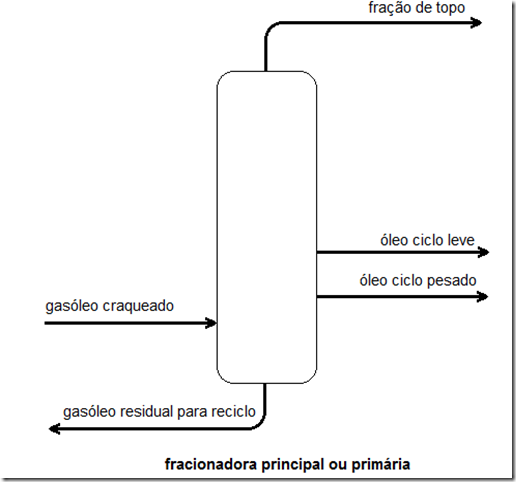
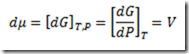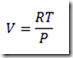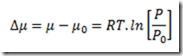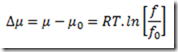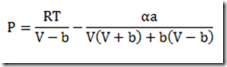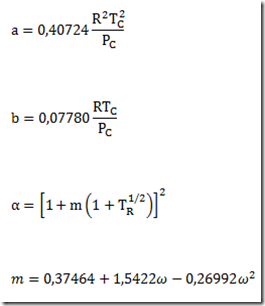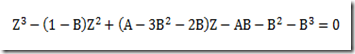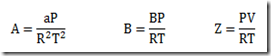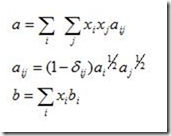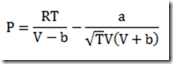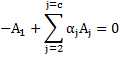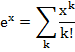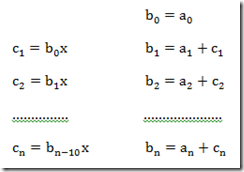Antes de explicar o que é fugacidade é melhor explicar o motivo de sua criação. A segunda lei da termodinâmica estabelece um conjunto de potenciais químicos para serem usados na solução de problemas. Estes potenciais para substâncias puras são:
Nos processos onde as variáveis selecionadas são P e T o potencial químico será a energia livre de Gibbs
Para processos envolvendo substâncias puras onde apenas a pressão varia
Se a substância for um gás ideal a equação de Clapeyron-Mendelev se aplica e
Inserindo na equação mais acima e integrando resulta
Esta expressão para calcular o potencial químico se caracteriza por uma simplicidade impar, mas só serve se a substância estudada for um gás ideal. E se não for um gás ideal como fica? Neste caso, uma equação de estado adequada deve ser escolhida e uma integração deve ser feita. A equação resultante não será simples.
Para manter a simplicidade, a pressão é substituída por um novo parâmetro proposto por Lewis e Randall denominado fugacidade e representado por f. Com isso, a equação fica
transferindo a complicação para este novo parâmetro. A fugacidade pode ter várias interpretações. Alguns gostam de chamá-la de "pressão química" para contrapor a pressão que seria uma "pressão física". Em todo caso, a fugacidade é um parâmetro fictício muito útil que está ligada as forças intermoleculares que caracterizam os fluidos não ideais..
A invenção deste novo parâmetro é creditada a Gilbert N. Lewis.Mais tarde publicou juntamente com Randall. Lewis nasceu em Weymouth, Massachusetts em 23 de outubro de 1875. Ele contribuiu para todos os campos da química. Morreu em 23 de março de 1946 em Berkeley.