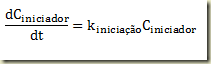Hoje, em 1741, foi inventada, pelo astrônomo Anders Celsius, a escala centígrada de medição de temperatura. Para isso, ele tomou como referência as temperaturas de congelamento e ebulição da água e dividiu o intervalo em 100 partes. Estranhamente, ele atribuiu o valor zero à temperatura de ebulição da água e o valor 100 a temperatura de fusão do gêlo. Depois que Celsius morreu inverteram a escala já que era contraintuitiva em relação as escalas existentes. A escala termométrica de Celsius é posterior às escalas de Fahrenheit, proposta em 1724, e de Réaumur, de 1731.
Anders Celsius nasceu em Uppsala, Suécia, como membro de uma grande família de astrônomos. Tornou-se professor em 1 730 e, dez anos depois, foi encarregado de dirigir um observatório recém-construído. Na astronomia pura, Celsius fez observações de eclipses e de vários objetos astronômicos. Publicou catálogos de magnitudes, cuidadosamente determinadas, para um total de 300 estrelas usando um sistema fotométrico próprio. Também se devem a Celsius importantes observações sobre a aurora boreal, que ele publicou em 1733. A seguir, é mostrado um termômetro onde a escala interna está em graus Celsius e a externa em graus Fahrenheit.

O grau Fahrenheit (símbolo: °F) é uma escala de temperatura proposta por Daniel Gabriel Fahrenheit em 1724. Nesta escala, o ponto de fusão da água é de 32 °F e o ponto de ebulição de 212 °F. O objetivo era evitar temperaturas negativas em Copenhague facilitando o registro. Assim, o valor 0°F correspondia ao frio mais intenso observado nesta cidade.
A escala Réaumur é uma escala de temperatura concebida em 1731 pelo frances René-Antoine Ferchault de Réaumir cujos pontos fixos são o ponto de congelamento da água (zero) e o seu ponto de ebulição (80 graus). Abaixo vemos uma placa da Rua Reaumur em Paris.

A seguir um “cut and past” da Wikipedia em português sobre a escala Newton de temperatura.
“Em meados do século XVII, o termômetro já era bastante famoso e usado na Europa. Cada fabricante tinha a sua própria escala para medir a temperatura. Era comum os termômetros terem no meio uma marca “l” para mostrar a situação de temperatura confortável. Acima desta marca havia 8 graus de calor e abaixo havia oito graus de frio. Como esse sistema era um tanto confuso, Isaac Newton pensou que deveria acontecer uma racionalização. Então ele propôs uma escala de temperatura na qual o ponto de congelamento da água fosse tomado como 0° N e a temperatura do corpo humano como 12º N. Estes eram os pontos fixos da escala Newton.” ("http://pt.wikipedia.org/wiki/Grau_Newton").
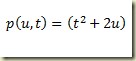
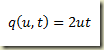
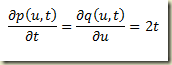








![Reblog this post [with Zemanta]](http://img.zemanta.com/reblog_e.png?x-id=62547a2d-d550-4a90-90a9-c11949d5525c)