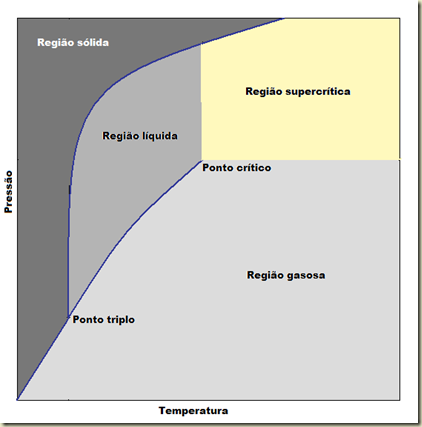
O diagrama abaixo é bem conhecido de todos. Ele é o diagrama de fase para uma substância pura bem comportada. Ele é um diagrama pressão versus temperatura a densidade constante. Nele podem ser vista três curvas azuis associadas a mudança de fases: uma ligando o ponto triplo ao ponto crítico que separa a região gasosa da região sólida e que corresponde a transição líquido-gás (condensação e vaporização), outra ligando o ponto triplo a origem do diagrama que separa a região sólida da região gasosa e que corresponde a transição sólido-gás (sublimação e solidificação). Finalmente, tem a curva que vai que vai do ponto triplo ao topo do diagrama a região sólida da região líquida e que corresponde a transição sólido-líquido (liquefação e vaporização).
A região amarela é a região que corresponde aos fluidos supercríticos. Esta região não tem fronteira definida. Não ocorre transição de fase quando o fluido supercrítico se transforma num líquido e nem quando ele se transforma em gás. Agora aqueles mais atentos vão perceber que existe uma transição de fase do fluido supercrítico e para o estado sólido em pressões elevadíssimas. Agora estamos em condições de definir fluido supercrítico. Qualquer substância será um fluido supercrítico se estiver submetida a temperatura e pressão maiores do que a temperatura e pressão críticas.
Por que esta região é interessante? Simples, porque nesta região o fluido não se define nem como líquido e nem como gás, mas pode ficar “mais parecido’ com líquido ou “mais parecido” com gás mediante a variação da temperatura e/ou pressão. Isso, por seu lado, mexe também com as propriedades do fluido como densidade, viscosidade, difusividade, entalpia, etc.. Por exemplo, a densidade de um líquido é em geral 1000 vezes a densidade do seu vapor, a densidade do fluido supercrítico correspondente pode variar entre estes valores pelo manuseio da temperatura e pressão. A sensitividade desta variação é maior quanto mais próximo estiver do ponto crítico. Mesmo tendo propriedades mais próxima do estado líquido o fluido supercrítico ocupa todo o espaço do recipiente como se fosse um gás.
Os fluidos supercríticos são completamente miscíveis entre si. Obviamente para isso as regiões supercríticas devem se superpor. Neste caso, o ponto critico é a média molar das propriedades críticas. Outra forma de obter o ponto crítico de mistura é usando equações de estado.
A engenharia química trabalha em temperaturas de centenas de graus abaixo da temperatura ambiental até pouco mais de um milhar de graus acima. Se puder optar entre refrigerar ou aquecer, ele vai preferir aquecer. No que se refere a pressão ele vai do vácuo até um milhar de atmosfera, preferindo pressurizar a fazer vácuo. Trabalhar em condições ambientais seria o nirvana da engenharia química.
Por isso, as substâncias cujos pontos críticos não estão muito afastados das condições ambientais são as preferidas para trabalhar. Isso acontece com o dióxido de carbono, por exemplo, cuja temperatura crítica é 31,1°C e cuja pressão crítica é 72,9 atm. O seu principal uso é como solvente extrator e um dos usos é na descafeinação. Água no estado supercrítico é usada na refrigeração de reatores nucleares. Outra substância muito usada e que se compara bem com dióxido de carbono nas condições operacionais é o etano cuja temperatura crítica é em torno de 32°C e cuja pressão crítica é 48,1 atm.