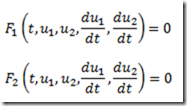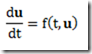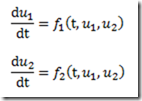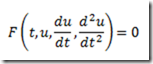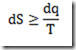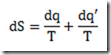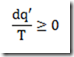Antes de 1953, os polímeros tácticos eram desconhecidos. Foi naquele ano, entretanto, que o químico alemão, Karl Ziegler, e engenheiro químico italiano, Giulio Natta, anunciaram a descoberta de catalisadores que permitiram o controle estereoquímico das reações de polimerização por adição. Estes catalisadores são conhecidos hoje como catalisadores de Ziegler-Natta.
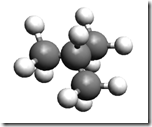
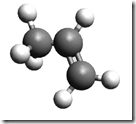
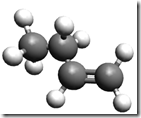
É mais fácil explicar através de um exemplo. Considere o propileno
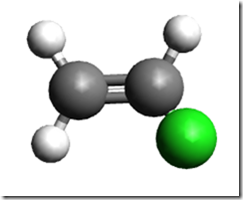
O grupo metil érepresentado pela esfera verde. Quando 0 propileno polimeriza, o resultado é o polipropileno. O termo táctico vem do grego "taktiko" que significa ordenado. Os polímeros tácticos, por sua vez, se dividem em: isotácticos e sindiotáticos. O arranjo molecular destes tipos de polipropileno é mostrado na figura a seguir.

Observando a figura acima, nota-se a diferença entre os dois arranjos. No arranjo isotáctico o grupo metil forma uma fila militar ao longo da cadeia polimérica. No arranjo sindiotáctico o cloro ziguezagueia ao longo da cadeia sem, porém, perder um ordenamento. Se a distribuição for aleatória o polímero é dito atáctico.
Obviamente, a estereoregularidade tem as suas vantagens. O polipropileno isotáctico, por exemplo, funde-se numa temperatura maior (176ºC) do que o polipropileno atáctico (35ºC). A resistência mecânica do polipropileno isotáctico é também maior. A maior parte do polipropileno comercializado é o tipo isotáctico.
Antes de 1953, os polímeros tácticos eram desconhecidos. Foi naquele ano que o químico alemão, Karl Ziegler, e o engenheiro químico italiano, Giulio Natta, anunciaram a descoberta de catalisadores que permitiam o controle estereoquímico da polimerização, hoje conhecidos como catalisadores de Ziegler-Natta.

Karl Ziegler nasceu em 26 de novembro de 1898 em Helsa, nas proximidades Kassel, Alemanha, sendo o segundo filho do pastor luterano Karl Ziegler e Luise Rall Ziegler. Estudou inicialmente na escola local. O seu interesse pela ciência foi deflagrada pela leitura de livros básicos de física. Estudou na universidade de Marburgo, sendo dispensado dos dois primeiros semestre pelos seus conhecimentos, onde recebeu o título de bacharel em química. Doutorou-se em 1920. Em 1926 tornou professor na Universidade de Heidelberg, onde estudou química orgânica durante 10 anos. Em 1952, Ziegler apresentou o seu catalisador para a empresa Montecatine para qual Giulio Natta atuava como consultor. Por este, catalisador receberam o prêmio Nobel de 1963. Ziegler descobriu o catalisador e Natta mostrou que ele era estereoespecifico. Carl Ziegler morreu em 11 de agosto de 1973 em Mulhein, na Alemanha.

Giulio Natta nasceu em 26 de fevereiro de 1903 em Imperia, nas proximidades de Gênova, na Itália. Formou-se em engenharia química pela Escola Politécnica de Milão em 1924. Em 1927 foi aprovado numa seleção para ministrar aulas de química na Politécnica de Milão. Foi professor e diretor do Instituto de Química Industrial da Politécnica de Turim de 1936 até 1938 quando retornou a Milão para assumir a direção do Departamento de Química Industrial da Universidade Politécnica onde permaneceu até 1974. Em 1938 começou suas investigações sobre polimerização de olefinas tendo publicado mais de 500 trabalhos nesta área. Em 1953, com o apoio financeiro da empresa Montecatine, estendeu os estudo conduzidos por Ziegler para polimerizações estereoespecificas. Foi neste estudo que surgiu a classificação em tático, atáctico, isotáctico e sindiotático. Em 1957 a Montecatine foi a primeira empresa a fabricar estes tipos de polímeros sob os nomes e Mole, Miralo, Mearim e Molecam.Detentor de muitos prêmios e honrarias. Giulio Natta faleceu em Bergamo em 2 de maio de 1979.