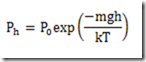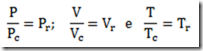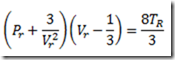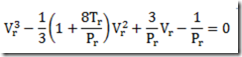A indústria química tem um efeito colateral: produz rejeitos. Por rejeito entende-se qualquer material que não pode ser aproveitado. Ele pode ser sólido, líquido ou gasoso. Os rejeitos gasosos são invariavelmente eliminados na atmosfera, mas, se for solúvel o destino pode ser os cursos d’água e o mar. Os rejeitos líquidos são descartados também nos cursos d’água, mas, se forem combustíveis, podem ser queimados para eliminação na atmosfera. Os rejeitos sólidos vão para o solo, mas, se o rejeito for solúvel pode ir para a água, se queimar pode ir para a atmosfera.
Não há como eliminar um rejeito verdadeiro, que não tem absolutamente uma utilidade conhecida. A lei da conservação da matéria de Lavoisier não deixa. Então, o que se faz é o gerenciamento do resíduo. Gerenciar é decidir onde ele será descartado: no solo, na água ou no ar. O ar é o nosso primeiro objetivo, por isso, a atmosfera entrou na nossa alça mira.
A atmosfera é o manto gasoso que envolve o planeta. Ela vai da superfície até cerca de 1000 km, quando se confunde com o espaço interplanetário. Este manto se mantém pela ação da gravidade.
Considerando a pressão, esta declina exponencialmente com a altitude indo da pressão ao nível do mar, 1 atm, para zero. Tomando a pressão ao nível do mar como referencia, a pressão cai a 1/10 deste valor a 16 km, a 1/100 a 30 km, a 1/1.000 a a 50 km, a 1/10.000 a 70 km, e a 1/100.000 a 90 km. Não existe uma fórmula exata, mas é possível chegar a uma fórmula aproximada desprezando a variação da temperatura
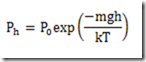
Na expressão acima m é a massa de uma molécula, g é a aceleração da gravidade, k é a constante de Boltzmann, T é a temperatura.
Considerando a temperatura o negócio se complica um pouco. É a variação da temperatura que define as camadas da atmosfera. São elas:
· Troposfera – Nesta camada a temperatura declina, indo da temperatura superficial a menos 58°C. A espessura desta camada vai de 12 km nos polos a 20 km no equador. Cerca de 80% da massa atmosférica está nesta camada. Entre a troposfera e a camada seguinte existe um pequeno trecho de 10 km onde a temperatura é constante chamada tropopausa.
· Estratosfera – Na estratosfera a temperatura sobe de menos 58°C para menos 8 graus a 50 km. Esta elevação de temperatura é causada pela camada de ozônio cujas reações liberam calor. Entre a estratosfera e a camada seguinte ocorre um pequeno trecho de 5 km onde a temperatura é constante chamado estratopausa.
· Mesosfera – É a camada seguinte onde a temperatura volta a cair atingindo menos 90°C a 80 km. Este é o ponto mais frio da atmosfera. Em seguida vem um trecho de 10 km onde a temperatura é constante conhecido como mesopausa.
· Termosfera - A termosfera vai até cerca de 700 km. Nesta camada a temperatura vai de menos 90°C até cerca de 2000°C. Novamente surge um trecho onde a temperatura é constante chamado de termopausa.
· Exosfera - A partir dai aparece a exosfera que vai até não ser possível distinguir do espaço interplanetário.
Considerando a composição a atmosfera contém duas camadas: homosfera e heterosfera. Na homosfera a composição não varia. Os gases ais pesados, nitrogênio, oxigênio e argônio predominam Esta camada vai até cerca de 100 km abrangendo a troposfera, a estratosfera e parte da mesosfera. A composição do ar em ppm nesta camada é:
Nitrogênio: 780.800 ppm
Oxigênio: 209.500 ppm
Argônio: 9.300 ppm
Neônio: 18 ppm
Hélio: 5.2 ppm
Metano: 1.0 ppm
Criptônio: 1.0 ppm
Os outros gases estão abaixo de 1 ppm. O dióxido de carbono no ar é 5.2 ppm. A quantidade de água é variável.
A partir dai começa a heterosfera cuja composição varia com a altitude. Nesta camada os componentes leves, hidrogênio e hélio, passam gradualmente a predominar.
A camada de ozônio se localiza na parte inferior da estratosfera indo de 10 a 30 km. A concentração de ozônio, nesta camada, varia entre 2 e 8 partes por milhão e 90% do ozônio existente na atmosfera está nela camada. Esta camada é importante para a vida no planeta por motivos que serão apresentados mais adiante.
A ionosfera é a camada entre 50 e 1000 km onde os componentes da atmosfera estão ionizados pela radiação solar. Ela é composta por íons e elétrons livres.
Mais tarde será visto a física e a química da atmosfera. Esclarecida a estrutura da atmosfera o destino da poluição atmosférica de origem industrial poderá ser discutido.