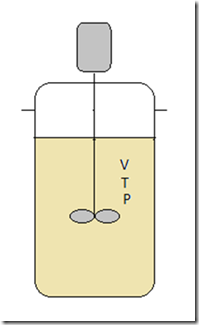
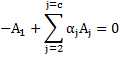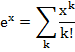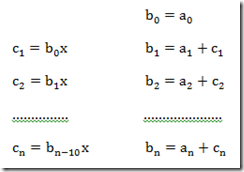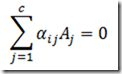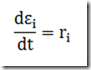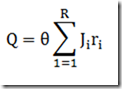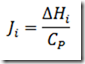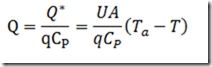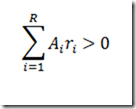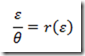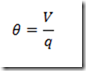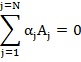A condição de isotermicidade evita que a equação de balanço energético seja considerada. Contudo, na pratica, a manutenção do regime isotérmico obriga que uma ação controladora atue sobre o trocador de calor para manter a temperatura constante durante a reação, especialmente se o fator adiabático for alto.
A forma geral das reações de primeira ordem onde a molecularidade é igual a ordem é
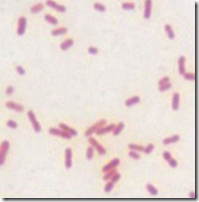
Todos os coeficientes estequiométricos dentro do somatório são positivos ou nulos. As reações de irreversíveis de primeira ordem obedecem á cinética
onde k é a constante de velocidade da reação.
Os casos a serem considerados aqui são:
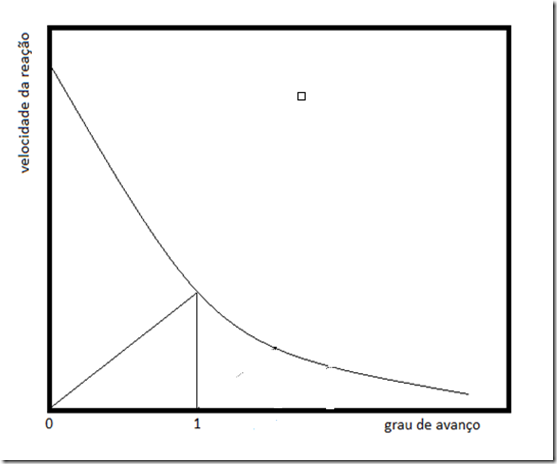
1. Reator de batelada isotérmico
A equação que rege este tipo de reator é
A solução deste problema é
Obviamente,
Disso resulta que
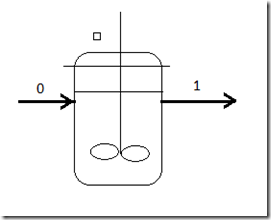
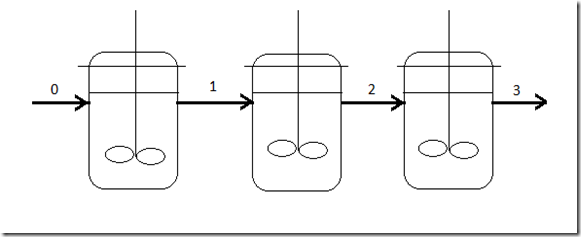
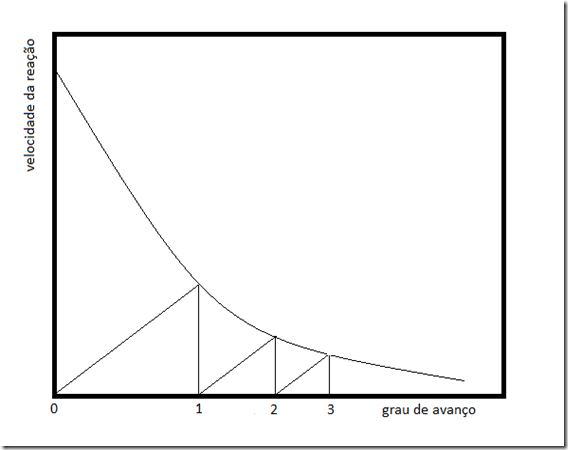
2. Reator contínuo isotérmico
Neste caso, o reator é governado pela equação
Existem dois problemas:
· Dado o grau de avanço desejado calcular o tempo de residência;
Calculado o valor do tempo de residência o problema de dimensionamento se resume a calcular a vazão dado o volume ou calcular o volume dado a vazão.
· Dado o tempo de residência, calcular o grau de avanço;
Conhecer o tempo de residência equivale a conhecer, ambos, o volume e a vazão. A equação acima fornece o grau de avanço. Para quem gosta de trabalhar com conversão, basta dividir o grau de avanço pela concentração inicial do reagente.