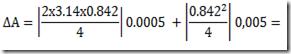
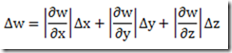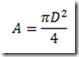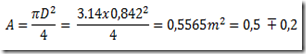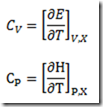No estudo da primeira lei da termodinâmica foram definidas duas capacidades caloríficas: a capacidade calorífica isocórica e a capacidade calorífica isobárica. As capacidades caloríficas são propriedades extensivas do sistemas definidas pelas relações:
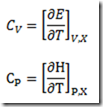
Ambas são interpretados como sendo a energia que deve ser fornecida ao sistema, na forma de calor, para que a temperatura deste aumente de um grau. Nas relações acima tanto E como H são propriedades extensivas. A determinação das capacidades caloríficas é um problema de termometria e envolve o uso de um calorímetro. A diferença está na forma de conduzir o experimento, se a volume constante ou a pressão constante. A capacidade especifica isobárica é mais fácil de ser determinada experimentalmente que a a isocórica.
A capacidade calorífica intensiva é conhecida como calor específico. Como acontece com a capacidade calorífica o calor específico pode ser isobárico ou isocórico. Ele também pode ser expresso por unidade de massa, por unidade de mol ou por unidade de volume.
Deixando de lado os sistemas reagentes e considerando apenas a capacidade calorífica isobárica, que é a mais usada, ela é uma função da temperatura tendo a pressão como parâmetro. A determinação experimental do calor específico a volume constante de materiais sólidos e líquidos é muito difícil de ser realizado porque a variação da pressão para que o volume se mantenha constante é muito grande.
Assim, experimentos calorimétricos são realizados visando à construção da curva da capacidade calorífica temperatura. Obtido os pontos necessários, a curva é obtida usando o método dos mínimos quadrados. A função preferida é
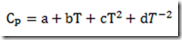
A principal restrição para este tipo de equação é que só pode ser aplicada na pressão em que foi calculada. A maioria dos polinômios tabelados valem para a pressão ambiental, isto é, 1 atm. A segunda é que só podem ser usados na faixa de temperatura em que foram calculados. Fora desta faixa passam a ser duvidoso.
Exemplo – A seguir está uma tabela de calores específicos do acetileno na pressão ambiente, uma atmosfera, temperatura em graus Celsius.

No SI o calor específico é expresso em kJ/(kg.ºC) Se um polinômio for obtido a partir destes dados, ele só valerá para a pressão ambiental e na faixa de temperaturas entre zero e quinhentos graus Celsius.
Exercício – Se sabe manejar com o método dos mínimos quadrados tente achar o polinômio a partir da Tabela de dados do exemplo acima. Claro que um software de álgebra computacional ou uma calculadora estatística simplificam a tarefa, mas é possível resolver na munheca.
Felizmente, alguns calores específicos variam pouco e assumir um valor médio para toda a faixa de temperatura é uma boa saída.
Exemplo – A seguir está uma tabela de valores do calor especifico da água liquida a pressão ambiental.

Dá para perceber que a influencia da temperatura pode ser desprezada e um valor médio usado entre 0ºC e 100ºC. Nos cálculos de engenharia, quando a faixa é estreita, é melhor usar o valor médio.