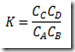Em algum lugar deste blog, não sei quando e nem onde, foi declarado que praticamente todas as operações unitárias poderiam ser realizadas simultaneamente com uma reação no mesmo equipamento. É o que acontece na destilação reativa. A reação é realizada num destilador que assume uma função dual, sendo ao mesmo tempo destilador e reator. Isso parece ser algo exótico e raro, mas não é. Basta colocar “reactive distillation” no google
Se a destilação for abordada como uma operação em estágios equilibrados, em cada estágio é suposto haver equilíbrio líquido-vapor e químico. Nada impede contudo o uso de estágios não equilibrados, onde as velocidades de transferência massa e de reação sejam considerados.
Considere a reação reversível que ocorre na fase líquida
onde, no equilíbrio
Ela poderia ser uma esterificação onde
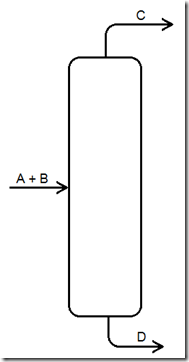
Obviamente a ordem de volatilidade afeta bastante o resultado. Admitindo que C seja mais volátil do que D, então vale a Figura a seguir
Obviamente, nada pode ser tão perfeito como mostrado acima, mas pode chegar bem perto, quem diz isso é a lei de Le Chatelier. Basta colocar a massa cinzenta para funcionar. O resto só em literatura especializada como a listada a seguir.
Em termos de projeto as colunas de destilação reativas é bem parecida com as não reativas. A única diferença é o acréscimo do equilíbrio químico nas equações de balanço.Os destiladores reativos pode ser usados industrialmente para realizar: eterificação (MTBE, ETBE e TAME); esterificação ou hidrolise; transesterificação; hidrogenação; hidrodesulfurização; hidrodenitrogenação; hidrocraqueamento, cloração, etc..