Por país (neste caso o sitemeter considerou os últimos 100 a entrarem):
Por mês:
Nos últimos trinta dias:
Trata-se de uma miscelânea sobre a engenharia química e áreas afins.
Por país (neste caso o sitemeter considerou os últimos 100 a entrarem):
Por mês:
Nos últimos trinta dias:
Saiu na edição de 24 de agosto da Chemical Engineering News
Muito pouco se sabe sobre o destino dos plásticos no meio ambiente, especialmente nos oceanos. Todos assumem que os plásticos não se decompõem na natureza, sendo, por isso um dos piores poluentes.
No entanto, cientistas japoneses, analisando a areia das praias de todo o mundo, encontraram produtos que só poderiam ser resultado da decomposição de materiais poliméricos. Para descobrir como poderiam ser produzido estes compostos por degradação nas condições existentes no ambiente oceânico, eles realizaram experimentos em laboratório. Nestes experimentos, o poliestireno liberou monômeros, dímeros, trimeros em temperaturas tão baixas como 30ºC. Um dos cientistas afirmou que esta decomposição poderá ser mais acentuada ainda no ambiente costeiro.
Para mais detalhes visitem o site da revista http://pubs.acs.org/cen/news/87/i34/8734news8.html
Hoje, em 1859, o Coronel Edwin Laurentine Drake, perfurou o primeiro poço de petróleo bem sucedido nos Estados Unidos. Antes, muitos poços jorraram petróleo, mas eram poços cujo objetivo era a água e o petróleo era um inconveniente. A perfuração tinha atingido pouco menos de 25 metros quando o petróleo começou a jorrar formando um filme sobre a água. Este não foi o primeiro poço perfurado com o objetivo exclusivo de encontrar petróleo no mundo, mas ele serviu como ponto de partida da indústria do petróleo e do gás dai a sua importancia. Para realizar esta perfuração Drake foi contratado pela Seneca Oil que o enviou para Titusville para começar a perfuração no ano anterior. A Seneca Oil destilava o petróleo para obter o querosene usado na iluminação de interiores em substituição ao óleo de baleia. Na iluminação de exteriores o gás era preferido.
A descoberta oficial de petróleo no Brasil ocorreu em 1939 em Lobato, um bairro na periferia de Salvador.
Quem nasceu hoje, em 1874, em Colônia na Alemanha, foi Carl Bosch, químico industrial da BASF, que, em 1913, juntamente com Fritz Haber, desenvolveu o processo de síntese da amônia em escala industrial conhecido como processo Haber-Bosch. Para isso, reagiram nitrogênio atmosférico com hidrogênio usando catalisador a base de ferro ativado. Os estudos que indicaram este catalisador como o mais apropriado foram realizados por Alwin Mittasch, também químico da BASF. Com isso, resolveram o problema da fixação do nitrogênio e deram um impulso considerável a indústria de fertilizantes.
Carl Bosch estudou no Instituto Politécnico de Charlottenburg, atual Universidade Técnica de Berlim, e na Universidade de Leipzig. Em 1899 começou a trabalhar na BASF. Em 1931 compartilhou com Friedrich Bergius o premio Nobel. Morreu em Heidelberg em 26 de abril de 1940.
A reação de síntese da amônia
tem uma característica interessante, a sua energia livre de Gibbs é favorável nas condições ambientais e desfavorável em temperaturas elevadas. O que isso significa? Termodinamicamente falando, a energia livre de Gibbs é o trabalho isotérmico reversível da reação quando os reagentes são transformados completa e estequiométricamente em produtos. Ela serve para calcular a constante de equilíbrio. Uma reação é favorável se a constante de equilíbrio for maior que um e desfavorável se esta constante for menor do que um. Valores da constante de equilíbrio maiores do que a unidade estão associados a valores negativos da energia livre e valores menores, a valores positivos. Isso afeta o rendimento da reação e aumenta ou diminui a quantidade de material a ser reciclado.
Já a velocidade da reação é desprezável nas condições ambientais, mas significativa em temperaturas elevadas. A velocidade da reação afeta o tamanho do reator. Quanto mais rápida a reação, menor o reator.
Para conciliar foi necessário elevar a pressão para diminuir a energia livre ao ponto dela se tornar negativa numa temperatura onde a velocidade fosse significativa. Assim, quanto mais alta a pressão e mais alta a temperatura melhor, desde que se respeite, é claro, os limites impostos pelos materiais usados na construção da unidade. No tempo em que a energia era barata, optava-se por trabalhar nas condições mais elevadas para poupar investimento de capital, mas hoje a energia não é mais tão barata e aumentar o investimento em material de construção passou a ser interessante. Consegue-se isso operando nas condições de temperatura e pressão mais baixas aceitáveis sob os pontos de vista técnico e econômico para desonerar os custos operacionais no que se refere ao consumo de energia.
Em minha opinião, a síntese da amônia e o craqueamento catalítico do petróleo são os processos onde a genialidade da engenharia química se revela em todo o seu poder. Se houvesse uma lista das sete maravilkhas da engenharia química estes dois processos estariam na lista com certeza.
Na Figura acima vemos um venturímetro, peça usada na medição de vazões volumétricas de fluídos incompressíveis, i.e., líquidos e gases a densidade constante. Ele é inserido na tubulação de forma a ser composto de cinco zonas, a tubulação a montante, o cone de entrada, o estrangulamento, o cone de saida e a tubulação a jusante.
O venturímetro foi proposto por Giovanni Battista Venturi observando escoamento em canais por volta de 1797, mas uma forma utilizável de venturímetro foi fabricada Herschel em 1887.
Admitindo que a vazão volumétrica é Q a velocidades nos pontos 1 e dois são dadas por:
Admitindo que não há perda de carga e que as pressões nos pontos 1 e 2 são, respectivamente, p1 e p2 e inserindo no principio de Bernoulli resulta:
Explicitando a vazão resulta:
onde
Os dois primeiros fatores do membro a direita são relacionado com a geometria do equipamento, ou melhor, com os diâmetos da tubulaçã e do estrangulamento. Fazendo
a equação do venturímetro fica
Como é o costume nestes casos um fator de correção chamado coeficiente de descarga é acrescentado a fórmula acima que fica então
A redução gradual da seção transversal ao escoamento no venturímetro o torna adequado para fluidos com sólidos em suspensão.
Nasceu hoje, em 1685, em Edmont, na Inglaterra, Brook Taylor, mais conhecido pela série que leva o seu nome. Esta série foi considerada, mais tarde por Lagrange como o principal fundamento do cálculo diferencial. Esta série foi objeto de uma briga de matemáticos ingleses com Jean Bernoulli, que afirmava que a série de Taylor era um plágio de sua série. No entanto, ambos não sabiam que tinham sido antecipados na descoberta desta série por Gregory. É considerado o criador do cálculo com diferenças finitas aplicando este cálculo à cordas vibratórias.
Sua família era moderadamente rica e ligada à baixa nobreza. Taylor teve aulas particulares em casa antes de entrar para o Saint John's College, Cambridge, em 1701. Estudou matemática com os catedráticos John Machin e John Keill. Taylor recebeu seu diploma de Bacharelado em 1709. Ingressou na Royal Society de Londres em 1712 e recebeu o diploma de Doutorado em 1714. Foi eleito secretário da Royal Society em janeiro de 1714, mas se demitiu em outubro de 1718 em virtude de sua saúde e talvez também pela perda de interesse nesta tarefa cansativa e extenuante.
Brook Taylor morreu em 1731 e foi enterrado em Londres.
Fazer uma análise química do petróleo com a identificação de todos os seus componentes é uma tarefa impossível. O numero de componentes é da ordem dos milhares e a quantidade de cada um é muito pequena. É possível fazer uma análise cromatográfica, mas apenas dos componentes mais leves com poucos isômeros e com até cerca de 10 carbonos.
Para complicar, a composição vai variar de poço para poço e, num mesmo poço, de horizonte para horizonte. Por esta razão, “a composição” do petróleo é feita, como faz a termodinâmica de misturas continuas, acompanhando uma propriedade que varie com o tamanho molecular. No caso do petróleo e seu derivados, a propriedade intensiva escolhida é a temperatura de ebulição e a quantidade extensiva o volume de destilado. A curva resultante é chamada curva de destilação.
Conceitualmente a curva de destilação é muito simples. Consiste em destilar um volume predeterminado do petróleo ou fração numa pressão também predeterminada acompanhando a temperatura de ebulição contra o volume destilado. O resultado é apresentado graficamente como curva volume versus temperatura. Elas podem ser feitas na pressão atmosférica ou sob vácuo.
O equipamento pode ser um balão acoplado a um condensador destes usados em laboratório de química. A temperatura é dada por um termômetro no gargalo do balão. Um volume de amostra do petróleo ou fração do petróleo é colocado no balão e aquecido. O vapor formado condensa e cai numa proveta onde o volume de destilado é medido em percentagem do volume de amostra. O resultado é a tabela abaixo:
Na Tabela acima IBP é acrônimo de Initial Boiling Point e corresponde a temperatura em que a primeira gota cai na proveta. EP é acrônimo de End Point e corresponde a temperatura em que a última gota cai na proveta. Nem sempre é possível destilar a amostra até o final e a temperatura é limitada pela temperatura onde começa o craqueamento, algo em torno de 300°C. Munido desta Tabela uma curva pode ser construída e esta é a chamada curva de destilação.
No entanto, a coisa não é tão simples assim. A destilação tem que ser feita seguindo rigorosamente a norma correspondente tanto nos procedimentos como nos equipamentos usados. As curvas que são realizadas de acordo com a norma ASTM são chamadas curvas de destilação ASTM. São elas ASTM D86, ASTM D1160, D2887. Nos laboratórios modernos esta destilação é feita automaticamente, a amostra é colocada no equipamento que constrói a curva.
A curva de destilação ASTM não mede de fato a temperatura de ebulição, mede a temperatura do vapor na passagem deste do balão para o condensador. Para obter os pontos de ebulição verdadeiros é necessário um equipamento um pouco mais sofisticado que fornece a curva TBP, onde TBP é acrônimo de "True Boiling Point".
Se a sofisticação for levado ao extremo de se considerar a temperatura do equilíbrio líquido-vapor então a curva resultante é a curva EFV, onde EFV é acrônimo de Equilibrium Flash Vaporization.
Curiosamente, conhecendo uma das curvas, a curva de destilação ASTM, é possível calcular todas as demais e em qualquer pressão. Para que servem? A partir delas é possível calcular o ponto de ebulição médio volumétrico. Conhecido este ponto e a densidade da amostra em °API é possível calcular o peso molecular da amostra, o calor de combustão, o fator de caracterização, o ponto de anilina, a pressão pseudocrítica e o calor latente de vaporização da amostra.
Em DEST 001 foi descrito o funcionamento da coluna de fracionamento apresentada abaixo. Esta é a coluna de fracionamento mais geral possível. Ela é alimentada por uma mistura bifásica (líquido + vapor). No topo é realizada a condensação parcial do vapor de topo e na base a vaporização parcial do líquido de base.
A alimentação divide a coluna em duas seções. A seção acima da alimentação é chamada seção de absorção. Nesta seção, o vapor absorve os componentes leves do líquido. A seção abaixo da alimentação é chamada seção de esgotamento. Nesta seção o líquido esgota os componentes pesados do vapor. Se estas seções forem separadas tem-se a situação mostrada na Figura a seguir.
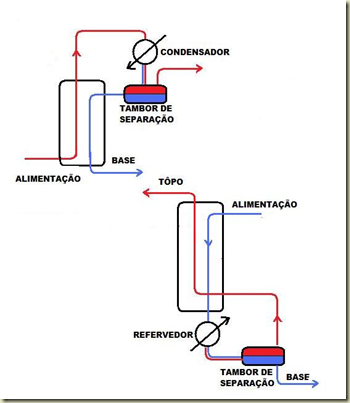
A coluna acima a esquerda é chamada coluna de absorção com com condensador. A coluna a direita é uma coluna de esgotamento com refervedor.
Além destas colunas de fracionamento existem mais que se caracterizam por não possuírem nem condensador e nem refervedor. Elas são mostradas nas Figuras a seguir.
Abaixo está uma coluna de absorção sem condensador. A alimentação é feita pela base na forma de vapor. No topo entra um líquido estranho ao processo cuja função é absorver componentes do vapor ascendente. Como todas as outras colunas, a mistura é dividida em fração de topo e de base.
Abaixo está uma coluna de esgotamento sem refervedor. A mistura a ser fracionada entra na forma líquida. Na base é introduzido um gás estranho ao processo, cuja função é esgotar alguns componentes leves do líquido descendente.
Os procedimentos de cálculo destes cinco tipos de colunas são bem parecidos e se baseiam no equilíbrio líquido-vapor. Existe outro tipo de coluna que se baseia no contato líquido-líquido, mas, por enquanto, está fora do escopo.
Esta recebi por e-mail de meu amigo Sebastião José de Melo, pesquisador de produtos naturais.
Conta-se que Rui Barbosa, "O Águia de Haya", um dia ao chegar em casa, ouviu um barulho estranho vindo do seu quintal.
Chegando lá, deparou com um ladrão com a mão na massa, pronto pra levar seus patos de criação.
Ele, Rui, aproximou-se vagarosamente do indivíduo e, surpreendendo-o ao tentar pular o muro com seus amados patos, disse-lhe:
- Oh, bucéfalo anácrono!
Não o interpelo pelo valor intrínseco dos bípedes palmípedes, mas sim pelo ato vil e sorrateiro de profanares o recôndito da minha habitação, levando meus ovíparos à sorrelfa e à socapa.
Se fazes isso por necessidade, transijo...
Mas se é para zombares da minha elevada prosopopéia de cidadão digno e honrado, dar-te-ei com minha bengala fosfórica bem no alto da tua sinagoga, e o farei com tal ímpeto que te reduzirei à qüinquagésima potência que o vulgo denomina nada.
E o ladrão, completamente confuso, diz:
- Dotô, eu levo ou deixo os pato?...